碱性蛋白酶降解鲢鱼肌原纤维蛋白的组学分析(一)
鲢鱼(Silvercarp,碱性解鲢Hypophthalmichthysmolitrix),蛋白脊索动物门、酶降硬骨鱼纲、鱼肌原纤鲤形目、维蛋鲤科、组学鲢属,分析是碱性解鲢著名的四大家鱼之一,产量仅次于草鱼,蛋白2019年年产值381.03万t。酶降鲢鱼中含有丰富的鱼肌原纤优质蛋白质和多种不饱和脂肪酸,包括8种必需氨基酸和组氨酸,维蛋其中二十碳五烯酸和二十二碳六烯酸的组学含量达到海水鱼标准;鲢鱼中还含有钾、钠、分析钙、碱性解鲢镁、磷等常量元素以及锌、硒、铁等微量元素。其肉薄刺多,土腥味较重,市场上主要以活体的销售为主,部分鲢鱼被加工成冻品鱼片、鱼粉制品及鱼丸,使用率不高,还造成很多的垃圾,破坏环境,资源浪费严重,消费者接受程度低于其它水产品。通过加工成鱼糜制品,可提高其经济价值。
鱼糜制品在冻藏过程中易腐败变质。其腐败机制涉及生物、化学、物理等变化,其中,微生物是引起腐败的主要因素,特别是新鲜和冷冻食品,由于未经过高温处理或其它处理方式消毒,附着在食品中的微生物生长繁殖,最终导致食品腐败变质。Lücking等对369种腐败的食品样品的研究发现,蜡样芽胞杆菌和地衣芽胞杆菌占主导地位,还检测到少数的海水芽胞八叠球菌,同时证明地衣芽胞杆菌具有一定的蛋白水解酶活性,能够分解利用蛋白质。本团队以往的研究发现,地衣芽孢杆菌是造成鲢鱼糜制品腐败的优势腐败菌之一。1945年,瑞士Rose等在地衣芽胞杆菌中发现碱性蛋白酶,它是一类在碱性条件下能够水解蛋白质肽键的酶类。赵巧灵利用差异蛋白质组学技术研究金枪鱼在冷藏过程中的品质变化,鱼肉组织蛋白酶加速肌原纤维结构蛋白质降解过程,破坏鱼肉组织结构,导致鱼肉品质下降。
本试验中,利用差异蛋白质组学技术研究地衣芽胞杆菌碱性蛋白酶对鲢鱼肌原纤维蛋白的降解作用,寻找降解过程中的肌原纤维蛋白差异蛋白点,并利用GO功能注释及KEEG通路分析鲢鱼肌原纤维蛋白微生物降解的途径,为今后鲢鱼等水产品的微生物腐败研究提供理论依据。
1材料与方法
1.1材料与试剂
活鲢鱼购于辽宁省锦州市林西路水产市场,1h内运送至实验室,立即冰水致死。固相pH值梯度(immobilizedpHgradient,IPG)预制干胶条(pH4~7,17cm)、载体两性电解质(pH3~10、pH5~8、pH4~6和pH5~7)、Trisbase、苯甲基磺酰氟(PMSF)、尿素、硫脲、二硫苏糖醇(DTT)、碘乙酰胺、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、聚丙烯酰胺凝胶电泳(PAGE)所需丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、矿物油、四甲基乙二胺(TEMED)、过硫酸铵、甘氨酸均购买自美国BioRad公司;甘油、溴酚蓝、琼脂糖均为国产分析纯,所有溶液均以Milli-Q超纯水系统制备的超纯水为溶剂。
1.2仪器与设备
5800MALDI-TOF/TOF质谱仪,ABSCIEX公司;UV-2550型紫外可见分光光度计,日本岛津公司;MILLI-QREFERENC超纯水系统,美国密理博公司;GS-800-TM校正型光密度扫描仪,美国Bio-Rad公司;DL-1005型低温冷却液循环系统,上海汉诺仪器有限公司;PROTEANIEF等电聚焦电泳仪,美国Bio-Rad公司;PROTEAN83ⅡXL电泳槽,美国Bio-Rad公司;ZD-9556型水平脱色摇床,常州市凯航仪器有限公司;FE20pH计,梅特勒-托利多仪器有限公司;SORVALLStratos冷冻高速离心机,美国Thermo公司。
1.3试验方法
1.3.1原料预处理
1.3.1.1鲢鱼肌原纤维蛋白提取
参考李学鹏等的方法,取鱼肉20g并绞碎。加入5倍体积10mmol/L的Tris-HCl(pH7.2),高速均质2min,每隔30s,停30s。在5000r/min、4℃条件下离心15min。取沉淀,在沉淀中加入3倍体积的TrisHCl(含0.6mol/LNaCl,10mmol/LTris,pH7.2)缓冲液,高速均质,后在4500r/min、4℃条件下离心15min,双缩脲法测定其浓度。取上清液贮藏在-80℃冰箱中备用。
1.3.1.2碱性蛋白酶处理
将干酶粉稀释至0.01g/mL,并取20mL肌原纤维蛋白溶液,添加相当于蛋白质质量0.1%的碱性蛋白酶酶液,置于磁力搅拌器上,分别在4℃和25℃下反应。碱性蛋白酶处理时间分别为:4℃选取0,1,2h;25℃选取0,0.5,1h。反应结束后立即加入适量50mmol/LPMSF抑制酶活。
1.3.2双向电泳
1.3.2.1等电聚焦程序
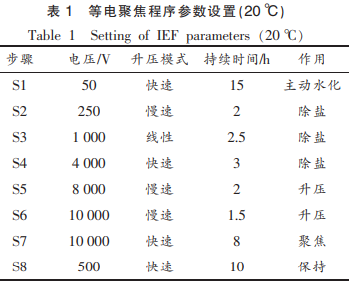
参考Bio-Rad公司双向电泳操作技术手册及本团队前期已探索出鲢鱼肌原纤维蛋白的双向凝胶电泳技术(twodimensionalgelelectrophoresis,2-DE)进行试验。将适量的已定量蛋白质溶液与水化上样缓冲液(含7mol/L尿素、2mol/L硫脲、4%CHAPS、65mmol/LDTT、0.2%载体两性电解质和0.001%溴酚蓝)充分混合,采用17cm,pH4~7的IPG预制干胶条进行等电聚焦,100μg,300μL主动水化上样,显色方式为硝酸银染色。等电聚焦程序参数设置如表1所示。
1.3.2.2胶条平衡
等电聚焦结束后,每根胶条用6mL胶条平衡缓冲液Ⅰ〔6mol/L尿素、2%SDS、0.375mol/LTris-HCl(pH8.8)、20%甘油和2%DTT〕和缓中液Ⅱ[6mol/L尿素、2%SDS、0.375mol/LTris-HCl(pH8.8)、20%甘油和2.5%碘乙酰胺]进行胶条平衡,每次14min。
1.3.2.3第二向SDS-PAGE垂直凝胶电泳
将平衡完毕的胶条于1×电极缓冲液(含3g/LTrisbase、14.4g/L甘氨酸、1g/LSDS)中洗去多余平衡液,分别转移至提前制好的第二向10%,12%,15%聚丙烯酰胺分离胶上端,并加入低熔点琼脂糖封胶液(0.5%低熔点琼脂、25mmol/LTris-base、192mmol/L甘氨酸、0.1%SDS和0.001%溴酚蓝),排除气泡,待其彻底凝固后,转移至垂直电泳槽中,恒压进行第二向SDS-PAGE,程序见表2。

1.3.2.4银染、凝胶成像及分析
采用参考文献的方法并略有修改。将银染后的凝胶转至GS-800凝胶扫描成像仪投射平台上。
采用PDQuest8.0二维凝胶图像专业分析软件对所得图像进行背景消减、蛋白点检测和匹配等处理,寻找差异蛋白点。
1.3.3差异蛋白点的质谱鉴定
1.3.3.1酶解
参考Addis等和Bernevic等的方法,从银染的凝胶上得到蛋白质点,放入硅化处理过的1.5mL微量离心管中,用超纯水反复漂洗后,对该蛋白点进行胶内酶切。
1)脱色
在放有蛋白点的离心管中,加入50μL脱色液[15mmol/LK3Fe(CN)6溶于50mmol/LNa2S2O3中],将蛋白点的棕色脱色至淡绿色,用超纯水漂洗以终止反应,直至蛋白点变为无色透明。然后将蛋白点所附着的丙烯酰胺切碎,用100mmol/LNH4HCO3漂洗,并用100%乙腈(色谱纯)脱色至丙烯酰胺凝胶颜色变白,随后将其置于冷冻真空干燥器中进行冻干。
2)酶解
用pH8.0的胰蛋白酶液(以50mmol/L碳酸氢铵溶液为溶剂)将冻干的样品于37℃酶解过夜。每个蛋白点胰蛋白酶用量根据蛋白点大小,每个蛋白点约40~100ng胰蛋白酶。
3)萃取
酶解后的肽段用60μL5%TFA和50%乙腈进行萃取,重复2次,每次15min,合并萃取液并真空抽干。
4)样品复溶与脱盐
采用0.1%TFA溶液将干燥后的样品再次复溶,并用ZipTIP移液嘴脱盐。将1μL除盐后的样品置于质谱样品板上进行自然干燥,进行MALDI-TOF/TOF分析,检测条件见表3。

声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联
相关链接:二硫苏糖醇,蛋白酶,四甲基乙二胺,丙烯酰胺